【主持人】:能否传授我们一些答题技巧?【安老师】:因为一般在考研复习过程当中,同学们都比较关心答题技巧。选择题一般考察的是对基础知识如概念和原理的熟练掌握程度,有时候也要考察灵活应用能力。下面就举几个例子,针对糖代谢知识点可以这样出题,下列途径中哪个主要发生在线粒体中?A糖酵解途径、B三羧酸循环、C磷酸戊糖途径、D糖原降解,这道题考察考生对于糖代谢各反应发生地点的了解,糖酵解发生于细胞溶胶;三羧酸循环发生于线粒体基质;磷酸戊糖途径发生于细胞溶胶;糖原降解也发生在细胞溶胶。因此这道题应该选B。从这个例题当中可以看出,一般选择题对基础知识点的直接考察。第二道题,磷酸果糖激酶最强的别构激活剂是?A.1,6-二磷酸果糖、B.ADP、C.2,6-二磷酸果糖、D.ATP,磷酸果糖激酶是糖酵解过程中重要的调节酶,它是一种别构酶,ATP是它的别构抑制剂,而2,6-二磷酸果糖是它的别构激活剂,因此这道选择C。完成这道题需要对糖酵解的调控很熟悉,但是基础是对于糖酵解过程中各个反应及酶的熟练掌握。由此可见,我们对于基础知识掌握是十分至关重要的。简答题考察大家对于基础知识的熟练掌握程度,能够对一些知识点进行简要概括和总结,这与选择题不太一样的地方。每道小题是8分,这道题有8小点答案,每一小点是1分,也可能有四小点答案,每一小点2分,同学们在总结答案的时候应该怎么把握。在这道题不要花费太长时间,要做到看到题目有思路。简答题一般在书上找到答案,平时复习的时候,应该进行适当总结,将书上内容总结概括起来,看到题目能够迅速想到怎么答题,简答题能够正确迅速答完以后,为后面分析论述题腾出大块时间。例如,如果问到蛋白质生物功能的多样性和DNA双螺旋结构的特征,在书上能找到答案,这需要平时稍加注意。如果在复习过程中整理这两道题的话,能够很快答上来。我认为难度比较大,而且分值比较高的是分析论述题,考察对知识点融会贯通,分析能力,综合能力,需要在基础知识之上进行总结和概括能力。对于分值大的题,拿到题不要慌张,要像愚公移山一样,一点一点吃掉,拿到题以后不要着急做答,要理清思路。因为答题的时候,如果思路清晰、条理清楚的话,这样试卷能够拿到高分,如果答的混乱,前后没有呼应,这样判卷的时候会觉得很乱,没有思路,这样的卷子不会拿到高分。如果大家在答分析论述题,实在没有思路的话,我建议大家先把题目当中一些出现的名词进行一下解释,这样的话一个名词解释可能就能拿到1-2分,再想下面应该怎样答题。这里体现到了名词解释的重要性,前几年有名词解释题型,但是改革以后没有这个题型了,但是不表示名词解释不重要,因为生物化学学科知识点也有很多是以名词形式出现的,大家对于名词解释还要熟练掌握,答简答和分析论述题可以用到。例如题目中先给出一些实验结果,然后问到蛋白质的结构与功能的关系,同学们先审题,将问题分解开来,先看蛋白质的结构,它有一级结构和高级结构,一级结构跟功能有什么关系,高级结构与功能有什么关系,这样把题分为两个方面,再这将两方面分解出来,从小的方面一点点解释出来,把答案框架充实起来。【主持人】:刚刚安老师介绍的非常详细,各位同学可以试下一安老师的办法。对于考研复习,有什么整体的复习策略?【安老师】:我建议以看书为主,做题为辅。“书中自有黄金屋”“读书破万卷,下笔如有神”,如果把书能够读懂、读通、读透的话,无论考场上题型和题目怎么千变万化,我们都能够做到应答如流,游刃有余,“万变不离其宗”。进行四轮复习:第一轮复习,把书通读一遍,尤其对跨专业考生,可能以前没有接触过这个专业书,在看专业书的时候,就会有一些困难,第一遍看书的时候,不要求把书上的内容弄通弄懂,只需要有大概的了解。第二轮复习,同学们就要仔细看书,这要求读懂,并且边看书边做笔记,重点知识要进行标注。第三轮复习,还是要认真看书,把书上的内容弄通弄懂,一边看书和自己总结的笔记,笔记一定要自己总结,这样能加深印象,别人总结的笔记,你看的话,我觉得的没有感觉,还是自己的笔记比较好。一边看书和自己总结笔记,一边做相应章节的习题,像我刚才推荐的习题集,市面上习题册门类很多,同学们挑选习题册的时候,要看前面对章节各个知识点总结好不好,最好有例题,然后对例题有详解,后面有习题,对习题也要有详解。尤其选择题,知道答案选B,但是我选的是A,为什么选B呢?如果这个习题册会对这个答案解释得比较详细的话,也是比较好的。做完相应章节学习之后,可以讲自己做错题誊写另一个本子上,可以做易错习题,冲刺的时候可以看一下。第四轮复习,就是现在所处的阶段,还是要看书,书上的内容,是一个基础,是最根本的,如果书上内容都不理解的话,拿过来就做题,就看别人总结笔记的话,这样如果考试考原题可以,但是不会考原题,希望同学们一定要以书为主,再怎么千变万化是离不开书上基础知识。看书要求对书上内容深刻了解,可以拓展书上内容,书上的内容不太懂,或者在别的方面也有涉猎,可以看看其他生物化学书怎么写,或者可以看看分子实用学是怎么总结的,制成习题集,要求熟练掌握。熟练掌握就是理解性记忆或者背诵性记忆,我在这跟大家讲解,我当时也有背诵记忆成份比较多,理解性记忆可能不太多,但是如果同学们看书读懂读通的话,理解性记忆比较好。临考试前几天,快速浏览书中的内容、自己总结笔记和习题集、易错题集等等,查漏补缺,切忌烦燥不安,这时候要稳扎稳打,把好最后关。考试当天要提前到考场,有助于克服紧张,平复自己心情。拿到卷子以后快速浏览一下试卷内容,对题型分值进行整体把握,做到心中有数,可以合理分配一下答题时间。对于分值较小的题,一看到题目想到答案的题,保证正确基础之上,快速把这些题答完,为后面分析论述题腾出一些时间。对于分值较大的题,分析论述题,花的时间要长一些,但是不要急于下笔,先把题审好,题目问的是什么,这点一定要弄清楚,考虑好答题框架,然后再答,不要盲目做答,否则的话卷面思路不清晰。以上我对大家复习策略的建议。【主持人】:谢谢安老师,非常细致的分析了阶段性复习。现在09年考研复习已经临近尾声,处于冲刺阶段,对于这一阶段的考生,你有什么建议或要求?【安老师】:现在是11月末,距离考研还有一个月零10天左右时间,处于冲刺阶段。有一些考生完成了前三轮复习,现在正在进行第四轮复习。由于临近考研,在这一阶段的话,有些同学表现出烦燥不安,存在害怕自己考不上的心理,因为那个时候我自己也是这样,非常理解大家。【主持人】:金融危机可能也有一些影响。【安老师】:是。这是一种正常的现象,这种情绪一旦出现的话,同学们不要压抑,适当放松自己,可以每天拿出十分钟或半小时时间听舒缓音乐或者体育运动,这样能够舒缓一下神经,让大脑不要持续疲惫,这样的话不仅不会浪费时间,而且还能够提高同学们复习效率。我当时考研的时候,我也是存在害怕自己考不上心理,当时复习的时候,有时候学不进去了,我就去看电视剧、电影、听听音乐,放松一下,但是这只是适当放松。当然处于冲刺阶段复习的话,还应该是抓紧时间的,我们可以每天拿出十分钟时间适当放松就可以了。经过数月来的紧锣密鼓考研复习,同学们感觉身心俱疲了,身体的机器总有一天倒下来,如果能够适当放松的话是很好的。但是我们还是要抓紧冲刺阶段复习,要戒骄戒躁,踏踏实实克服紧张心理。如果复习得很充分很好的话,我们自然心里有底,考试的时候就不会紧张,在这一阶段的时候,如果同学们处理得不好的话,就会出现厌学心理,从放松到放任自己到松懈,甚至放弃考研,这时候调整好心态是十分重要的。我曾经对自己说过,我已经很努力复习了,如果考不上的话也没有什么遗憾,过程比结果更重要。【主持人】:对于专业知识方面,你能否为我们讲解一下什么是生物化学?【安老师】:生物化学就是生命的化学,用化学术语阐释生命现象和本质的学科,研究生物体的组成和生物化学变化,对于生物化学研究可以分成动态和静态。静态部分是指构成生物体的各组分的化学,就是生物大分子结构与功能,包括蛋白质化学、核酸化学、脂类化学等等。动态部分是指生物体内的一些物质代谢反应和遗传信息的传递过程,包括糖代谢、脂类代谢、氨基酸代谢、核苷酸代谢、DNA、RNA和蛋白质生物合成等等。【主持人】:蛋白质这一章有一些重点和难点,应该如何掌握?【安老师】:下面以两道例题形式总结一下知识点,这道题比较难总结的,所以在这里给大家一个建议。例如为什么蛋白质一级结构决定高级结构?拿到这道题以后,多肽链的折叠是在自然条件下自发进行的,蛋白质分子总是采取最低自由能的构象状态,形成蛋白质分子所特有的三级结构。蛋白质的一级结构是指多肽链中各氨基酸的排列顺序,蛋白质的一级结构包含着蛋白质分子的结构信息。例如有两方面的实验研究说明这种决定关系。第一实验是蛋白质的复性研究:当核糖核酸酶在尿素存在下,用巯基乙醇处理后,分子内的二硫键还原为巯基,肽链伸展成无规卷曲,同时酶的活性丧失;但是用透析的方法将尿素和巯基乙醇除去后,在有氧的情况下,松散的多肽链自发地折叠成与天然酶完全相同的三级结构,酶的活性几乎全部恢复。8对巯基的配对组合方式有很多种,但是酶复性时只选择了一种,说明多肽链的一级结构所包含的结构信息决定了酶的高级结构。第二个实验人工合成蛋白质:1965年我国科学家人工合成了牛胰岛素,在特定的溶液中该蛋白质即呈现全部的胰岛素活性,并可以形成与天然胰岛素相同的结晶,这表明线性的多肽链可以自发地折叠成独特的三级结构,蛋白质三级结构是由它的一级结构所决定的。第二道题,蛋白质结构与功能的关系?各种蛋白质都有其特定的生物学功能,而这些功能都与蛋白质分子的特定结构密切相关,因此蛋白质功能取决于以蛋白质一级结构为基础的蛋白质的空间构象。下面看一下蛋白质一级结构与功能的关系,分成两个小方面来说明。一是一级结构的变异与分子病,蛋白质中氨基酸序列与生物功能有密切的联系,如果一级结构发生改变,导致蛋白质生物功能的改变。如镰刀状细胞贫血症,就是由于血红蛋白一级结构变化引起的一种分子病。由于beta链第6位氨基酸由极性亲水的谷氨酸变成了非极性疏水的结氨酸,使血红蛋白分子易发生凝聚,从而导致红细胞变成镰刀状,而且易破裂,引起贫血。二是一级结构与进化,比较各种不同生物的细胞色素C的一级结构,发现其中与人类亲缘关系越远的生物,其细胞色素C的结构差异越大。研究者根据各种生物细胞色素C氨基酸序列的差别和相同之处所绘制的进化树与经典形态分类学所绘制的进化树是一致的,这表明蛋白质的进化反映了生物的进化。高级结构域功能的关系:核糖核酸酶的变性与复性。天然核糖核酸酶含有4对二硫键,在变性因素作用下,球状分子变成松散的多肽链,酶活性丧失;但当除去变性因素后,经氧化酶又可恢复原来的天然构象,二硫键是以正确的方式形成,酶活性恢复。蛋白质的变构效应:一些蛋白质由于受到某些因素的影响,其一级结构不变而高级结构发生改变,从而导致蛋白质生物功能的改变,这种现象称为变构效应。协同效应是变构效应的一种,是亚基间的相互作用,以血红蛋白为例,血红蛋白未与氧结合时,处于紧密状态与氧的亲和力低,当其中一个亚基与氧相结合后,构象发生改变,进而引起其它亚基构象改变,使得所有亚基的血红素铁原子的位置都变得适宜与氧结合,所以血红蛋白与氧的结合加速。【主持人】:实验题怎么答?【安老师】:复习实验题的时候,大家应该重点掌握是实验原理,一般出题有的时候会直接问到某个实验原理是什么,也有可能给一些实验数据让考生进行分析。但是不管哪种形式都离不开实验原理,因此实验原理作为基础知识是非常重要的。例如,SDS聚丙烯酰胺凝胶电泳法测定蛋白质分子量的原理,同学们可以先理清一下思路,为什么选择电泳法来分离蛋白质,并且电泳迁移率与哪些因素有关,再讲一下为什么选用SDS,然后再讲具体测定方法和原理。蛋白质生物大分子在一定PH条件下,蛋白质分子带有电荷,可在电场中游动,电泳迁移率与蛋白质分子大小即分子量,形状和所带电荷有关。SDS-十二烷基硫酸钠,是一种蛋白质变性剂,它与蛋白质的结合能够改变蛋白质的带电情况和分子形状。因此,当蛋白质电泳时,迁移率只与蛋白质分子大小即分子量有关。在巯基乙醇的存在下,SDS使蛋白质变性,亚基分开,多肽链伸展后SDS以1.4:1的重量比结合上,SDS带负电,使多肽链覆盖上相同密度的负电荷,消除原来的电荷差异,SDS-蛋白质复合体呈棒状,因此迁移率只受分子量的影响。用已知分子量的标准蛋白质在同样下电泳,分别测出迁移率,绘制成标准曲线,测出未知蛋白的迁移率,再与标准曲线进行对照查出分子量。凝胶过滤法分离蛋白质的原理?根据的是不同大小的蛋白质分子所经过的路径不同,分子量大的蛋白质由于不能进入凝胶颗粒的网状结构中而通过间隙先流出层析柱,而分子量小的蛋白质由于进入到凝胶颗粒中而后流出柱子,从而达到分离的目的。羟基磷灰石层析和亲和层析分离核酸的原理?首先要对核酸的结构和性质有所了解,有助于理解性记忆。羟基磷灰石表面上的带正电基团可与磷酸基相互作用,能够将单链DNA和双链DNA分离开。在低浓度磷酸盐缓冲溶液中,这两种DNA无都能被结合,随浓度提高,单链DNA解吸附,浓度进一步提高使双链DNA解离下来。根据真核生物mRNA的3端存在在polyA尾的结构特点,可以用polyU-琼脂糖层析柱亲和吸附真核生物mRNA,大分离纯化的目的。【主持人】:如果遇到计算题,如何解决?【安老师】:以两道例题形式给大家讲解一下,同学们拿到计算题先找到切入点。根据蛋白质相对分子质量,可以推算出蛋白质多肽链的长度。实验中分离得到的一种蛋白质,测知其相对分子质量为176000,如果这条多肽链是阿尔法-螺旋结构,它的长度?如果是单股beta-折叠,它的长度?大家先想一下这道题所隐含的条件是氨基酸的平均相对分子质量是120,这些基本的常数在平时的时候应该记住。比如DNA分子中碱基的平均相对分子质量是650等等。解题思路找到切入点,题目要求计算出多肽链的长度,先计算出多肽链所具有的氨基酸个数再乘以相邻两个氨基酸之间的距离,可以得出多肽链的长度。对于多肽链所含的氨基酸的个数,可以用蛋白质分子量除以氨基酸的平均分子量得到,176000/120=1467,相邻两个氨基酸之间的距离在阿尔法-螺旋结构中为0.15nm,在beta-折叠中为0.35nm,因此长度分别为1467×0.15=220nm,1467×0.35=513nm。计算1分子软脂酸经过beta-氧化所产生的能量:16碳脂肪酸经7次beta-氧化产生8个乙酰铺酶A,7个NADH和7个FADH2。8个乙酰铺酶A进入柠檬酸循环产生96个ATP,7个NADH进入呼吸链产生21个ATP,7个FADH2进入呼吸链产生14个ATP,共计产生131个ATP,再减去脂肪酸活化时消耗掉的2个高能磷酸键,因此,一分子脂肪酸beta-氧化产生129个ATP。【主持人】:在遗传信息传递这一部分,有许多涉及真核原核比较的题,怎么回答?【安老师】:由蛋白质执行生物功能,这是遗传信息传递的一个过程。这在部分当中,有一些涉及到真核原核比较问题,我对这一问题进行总结三道题,作为例题给大家讲解一下。中心法则:生物体的遗传信息由DNA传递给RNA再传递给蛋白质,由蛋白质执行生物功能,它是生命的体现者。原核生物和真正生物DNA复制的特点是多起点,双向复制,多个复制子,原核生物DNA复制是单一起点复制;冈崎片段长度比原核生物中的短;真核生物第一轮复制尚未完成不会开始第二轮复制,而原核生物可连续发动复制;真核生物DNA复制后,还要组装成核小体,而原核生物不形成核小体结构;真核生物还存在端粒的复制,而原核生物不存在这种复制。原核生物和真核生物的转录调节有什么不同?原核生物:1功能上彼此相关的结构基因和控制部位组成操纵子,作为基因表达调节的单位。 2调节元件种类少,有激活蛋白质和阻遏蛋白质的结合位点。3常以负调节为主,调节因子活性常受变构效应调节。4不存在染色质水平的调节。真核:1真核生物基因不组成操纵子,每个基因都有自己的基本启动子和调控元件。2存在大量顺式作用元件和反式作用因子,调节更复杂。3调节以正调节为主,调节因子常受到共价修饰。4真核生物具有染色质结构水平上的调节——染色质改型。原核生物和真核生物蛋白质合成的差异?1原核生物转录和翻译是偶联的,而真核生物不存在这种偶联关系。2原核生物的起始tRNA经历甲酰化反应,形成甲酰甲硫氨酰-tRNA无,真核生物的则不经甲酰化。3采取不同的机制识别起始密码子,原核生物依靠SD序列,而真核生物依靠于帽子结构。4原核生物的mRNA与核糖体小亚基的结合先于起始tRNA与小亚基的结合,而真核生物的起始tRNA与核糖体小亚基的结合先于mRNA与小亚基的结合。5在原核生物蛋白质合成的起始阶段,不需要消耗ATP,而真核生物需要消耗ATP。6参与真核生物蛋白质起始阶段的起始因子比原核生物复杂,释放因子则相对简单。7原核生物与真核生物在密码子偏爱性上有所不同。 【主持人】:非常感谢安老师详细的解答,最后请安老师总结一下。【安老师】:希望大家再接再励,把握好冲刺阶段的学习,继续坚持把最后这段考研历程走完,然后在考场上取得最后的胜利。预祝大家考研取得圆满成功,用一首诗来鼓励大家,“梅花香自苦寒来,宝剑锋从磨砺出”。【主持人】:谢谢网友的参与,本次活动结束,谢谢!
更多精彩资讯请关注查字典资讯网,我们将持续为您更新最新资讯!
查看全部
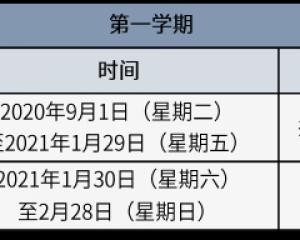 北京中小学8月29日起分批错峰开学 2021年1月30日放寒假-查字典资讯网2020-09-15
北京中小学8月29日起分批错峰开学 2021年1月30日放寒假-查字典资讯网2020-09-15
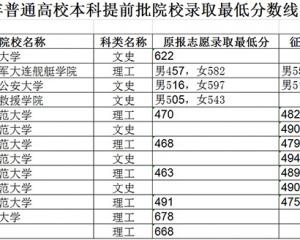 黑龙江:2020年普通高校本科提前批院校录取最低分数线-查字典资讯网2020-08-19
黑龙江:2020年普通高校本科提前批院校录取最低分数线-查字典资讯网2020-08-19 交叉学科将成第14个门类,这些高校早已抢占先机!2020-08-10
交叉学科将成第14个门类,这些高校早已抢占先机!2020-08-10 2021考研招生简章已公布?汉族考生也可享受“少干计划”的降分优惠?-查字典资讯网2020-08-06
2021考研招生简章已公布?汉族考生也可享受“少干计划”的降分优惠?-查字典资讯网2020-08-06